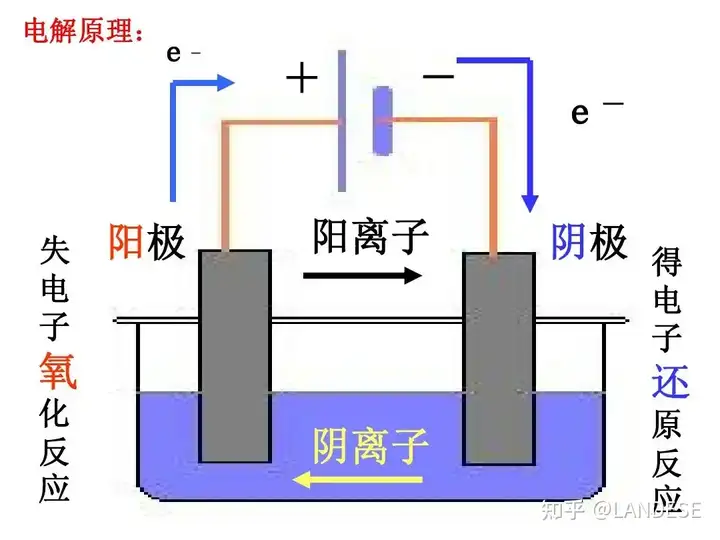
电解(Electrolysis)是将电流通过电解质溶液或熔融态电解质,在电解槽(见图1)阴极和阳极上引起氧化还原反应进行化学品的合成、高纯物质的制造以及材料表面的处理的过程的过程,电化学电池在外加直流电压时可发生电解过程,电解槽内发生虚实运流电流,电解槽外发生虚实传导电流。
英国物理学家和化学家M.法拉第在总结大量实验结果的基础上,于1834年所确定的关于电解的两条基本定律。
电解第一定律
在电极上析出(或溶解)的物质的质量m 同通过电解液的总电量Q(即电流强度I与通电时间t的乘积)成正比,即
m=KQ=KIt,
其中比例系数K的值同所析出(或溶解)的物质有关,叫做该物质的电化学当量(简称电化当量)。电化当量等于通过1库仑电量时析出(或溶解)物质的质量。
当通过各电解液的总电量 Q相同时,在电极上析出(或溶解)的物质的质量 m同各物质的化学当量C(即原子量A与原子价Z之比值)成正比。电解第二定律也可表述为:物质的电化学当量K同其化学当量C成正比,即
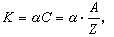
式中比例系数 α对所有的物质都有相同的数值,通常把它写成 1/F,F 叫做法拉第常数,简称法拉第,其值为9.648455×104库仑/摩尔。
电解电压可由能斯特方程计算:
E=E0−RTnFlnα1a2=E0+RTnFlnα2a1E=E_{0}-\frac{RT}{nF}ln\frac{\alpha_{1}}{a_{2}}=E_{0}+\frac{RT}{nF}ln\frac{\alpha_{2}}{a_{1}} , a1a_{1} 为生成物 Πaiυi\Pi a_{i}^{\upsilon_{i}} , a2a_{2}为反应物 Πajυj \Pi a_{j}^{\upsilon_{j}} 。
两极放电顺序:
阴离子:S2->I->Br->cl->OH->SO42->F-;
阳离子:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
注:铝离子,镁离子,钠离子,钙离子,钾离子得电子能力远远小于氢离子得电子能力,所以这些离子不能在水溶液条件下在电极(阴极)析出;但在熔融状态下可以放电。三价铁离子在阴极上得电子生成亚铁离子。电压效率是电解时电解质的理论电解电压与实际电解电压之比,后者即是电解槽的槽电压。分解电压即指使电解质在电极上分解生成电解产物所需施加的最小电压。槽电压通常远大于理论电解电压,导致电压效率很低。超电压是由于极化作用使阴极电位降低或阳极电位升高,其偏离平衡电位的绝对值,称为超电压或极电位。超电压现象有很大的理论意义和实用价值,它会使电化顺序逆转,特别是氢的超电压。例如在电位序表中氢以前的金属超电压很小而氢的超电压则很大。超电压越小的金属越容易析出来,所以电解时氢不析出而这些金属却能从溶液中析出来。我们也可以选用不同的电极来控制电解产物。例如拿合有 Zu2+Zu^{2+} 和 H+H^{+} 的溶液来说,在电解时,如果选用铂作电极,则因铂对氢的超电压很小,所以在这种情况下,氢的分解电压低于锌的分解电压,因此先析出的是氢而不是锌。如若改用锌作电极,则因锌对氢的超电压很大,所以锌的分解电压低于氢的分解电压,因此先析出的是锌而不是氢了。
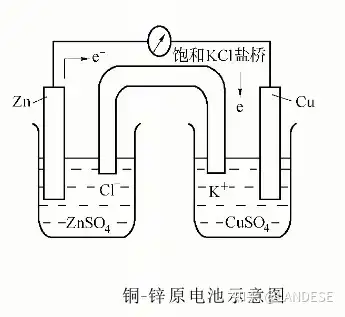
在电化学电池中,发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。在图2所示的铜-锌原电池中,阳极和阴极上发生的氧化还原反应如下:
阳极(锌极、负极): Zn−2e→Zn2+Zn-2e→Zn^{2+}
阴极(铜极、正极): Cu2++2e→CuCu^{2+}+2e→Cu
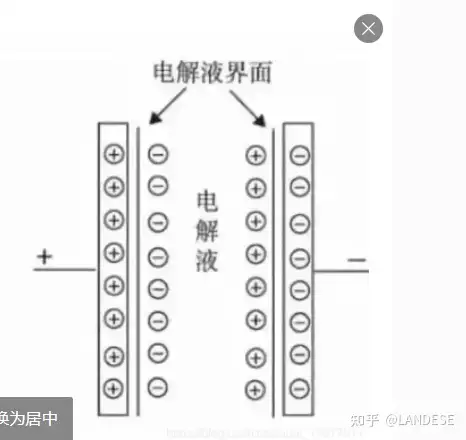
下图电化学电池由于化学势的作用在两电极和溶液之结合处形成两个反极双电层,其中在溶液内的电层中和致使两电极上有电荷和电势差而导电。
电化学电池电压可由能斯特方程计算:
E=E0−RTnFlnα1a2=E0+RTnFlnα2a1E=E_{0}-\frac{RT}{nF}ln\frac{\alpha_{1}}{a_{2}}=E_{0}+\frac{RT}{nF}ln\frac{\alpha_{2}}{a_{1}} , a1a_{1} 为生成物 Πaiυi\Pi a_{i}^{\upsilon_{i}} ,a2a_{2} 为反应物 Πajυj\Pi a_{j}^{\upsilon_{j}}。

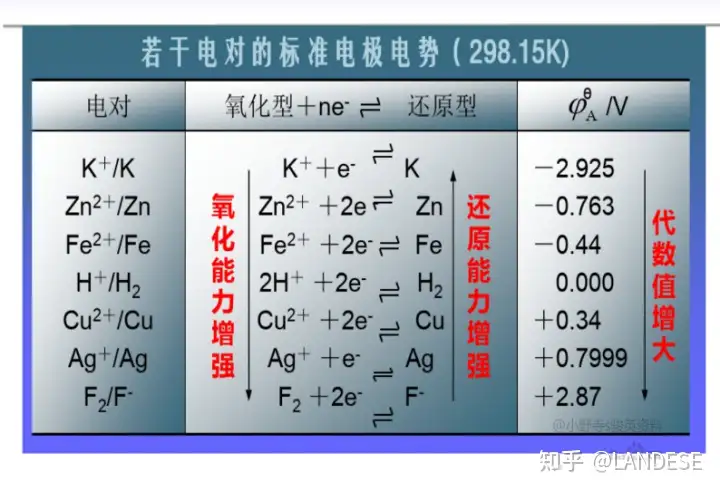
固态电池是一种使用固体电极和固体电解质的最完美的电池,但现在开发的固态电池不成熟导致成本高,而没有商业运用。本设想了由正电容电芯组成的固态电池如图3所示:
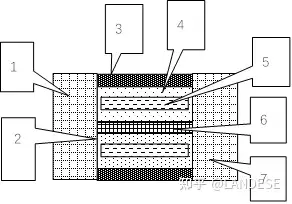
图3上,1填充在导电网格里面的电池金属负极。2只有金属电极离子能通过的隔膜。3包住正电容电芯的薄绝缘乳胶紧固套。4包住带电子型负电的绝缘薄片金属电极的薄绝缘塑料套。5由薄绝缘塑料套包住的带电子型负电的绝缘薄片金属电极。6带离子型正电的导电薄片金属电极。7电池正极上填充在导电网格里面的电池氧化物正极。
图3上的正电容电芯很薄由多个负极和正极依次并排组成,这些电极的极间电压很小且带电量很大,其导电薄片金属电极的正离子很自由灵敏,容易流动形成正离子实运流电流,其绝缘薄片金属电极形成电子虚传导电流。正电容电芯固态电池成本低便宜、制造简单内阻小、储能大(估计是普通化学电池的几倍)、充电速度快(估计只要几秒钟而普通化学电池要30几分钟)、寿命无限、安全、高低温都适用,适合手机、笔记本、电动车、军械、即时存储太阳能所发电能等使用。
场缚常温超导体
普通高温超导体很难制造,本人设想如图2.1所示的可以用电场束缚来代替冷却的负电容电芯场缚常温超导体,
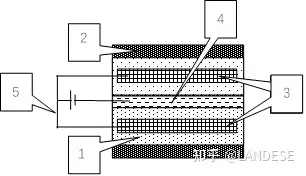
1包住带离子型正电的绝缘薄片金属电极的薄绝缘塑料套。2包住场缚常温超导体的薄绝缘乳胶紧固套。3由薄绝缘塑料套包住的带离子型正电的绝缘薄片金属电极。4带电子型负电的导电薄片金属电极。5充电电源,充满电后就撤去充电线路。
场缚常温超导体的带电子型负电的导电薄片金属电极的电子纵向上在两边带离子型正电的绝缘薄片金属电极正电场的束缚下抵消温度解离形成横向上变得更加自由灵敏的库伯对而形成共价π键,则该场缚导体的负极就可能会成为常温超导体。
磁电联解
单纯电解由于受电化顺序的影响,许多金属无法电解出来,本人设想的磁电联解不受电化顺序的影响可以电解出所有金属。磁电联解就是将溶液装在同轴输出/输入物质管环形磁解槽(TU槽)(见图5)中,该槽两极附近加离子交换膜隔绝气体,阳极有栅格电极,将装满溶液的TU槽放在永磁铁磁场中旋转,则溶液离子在洛伦兹力的作用下向电极靠拢聚集,再在两电极间通电电解,磁场中旋转的TU槽本身就会发电则该TU槽电解不需要外接电源,当大部分溶液离子向电极靠拢聚集时放出水继续电解,化学反应方程:
1.TU槽发生少量 H2oH_{2}o 电解:
H2o=H2↑+O2↑H_{2}o= H_{2} ↑+O_{2}↑
2.TU槽 发生 MgSO4MgSO_{4} 等运流和位移电流电解:
MgSO4=Mg+SO3↑+O2↑MgSO_{4}=Mg+SO_{3}↑ +O_{2}↑
磁电联解由于电阻极低可以低成本电解水、电渗析、提取所有金属、提取Mg合成氮肥、电解难溶物、大规模化学储电和电解金属制氢开车、开飞机、开坦克、开农机、开战车等。
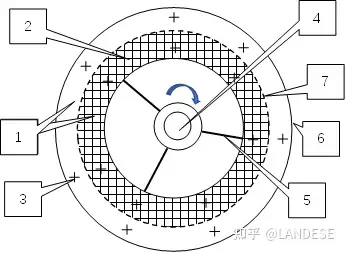
图5上,1环形磁解槽.2栅格阳极.3永磁铁磁场。4共同旋转同轴管.5输出/输入物质管。6阴极。7离子交换膜。




 客服
客服